Präanalytik für die Klinische Chemie
Fehlerhafte Analysenergebnisse können in verschiedenen Bereichen des Untersuchungsprozesses verursacht werden (Präanalytik, Analytik, Postanalytik). Während die Bereiche der Analytik und Postanalytik ausschließlich vom Labor beeinflusst werden können, kommt der Präanalytik eine besondere Bedeutung zu. Hier können Fehler verursacht werden, welche durch die nachfolgende Analytik nicht mehr auszugleichen sind.
Cave! Fehler in der Präanalytik sind die häufigsten Ursachen für Laborbefunde, die nicht zum klinischen Bild passen.
Für Informationen, Auskunft über Untersuchungen und Probenmaterial sowie Rückfragen und spezielle Auskünfte können Sie uns gern kontaktieren.
Weitere Informationen entnehmen Sie bitte unserem:
Letzte Änderungen: 02.12.2025
Hinweise zur Bearbeitungsdauer:
Bitte beachten Sie, dass die tatsächliche Bearbeitungsdauer in Einzelfällen abweichen kann, z. B. aufgrund von medizinischer Dringlichkeit, methodenspezifischen Anforderungen oder externen Versandzeiten. Bei Rückfragen zur Bearbeitungszeit stehen wir Ihnen gerne zur Verfügung.
Hinweise zur Präanalytik:
Die Präanalytik spielt eine entscheidende Rolle für die Qualität und Verlässlichkeit laboratoriumsmedizinischer Untersuchungen. Trotz der Einhaltung aller qualitätsgesicherten Prozesse und Maßnahmen zur Fehlervermeidung bleibt ein gewisses Restrisiko bestehen, das durch unterschiedliche Faktoren beeinflusst werden kann, z. B. präanalytische Variationen, unzureichende Probenqualität oder unvorhersehbare externe Einflüsse. Wir haben in unseren Laboren Maßnahmen etabliert, die sicherstellen, dass dieses Restrisiko auf ein absolutes Minimum reduziert wird und Einsender frühzeitig über mögliche Einschränkungen informiert werden, um eine optimale Patientenversorgung zu gewährleisten.
Hinweise zum Restrisiko:
Die Präanalytik spielt eine entscheidende Rolle für die Qualität und Verlässlichkeit laboratoriumsmedizinischer Untersuchungen. Trotz der Einhaltung aller qualitätsgesicherten Prozesse und Maßnahmen zur Fehlervermeidung bleibt ein gewisses Restrisiko bestehen, das durch unterschiedliche Faktoren beeinflusst werden kann, z. B. präanalytische Variationen, unzureichende Probenqualität oder unvorhersehbare externe Einflüsse.
Wir haben in unseren Laboren Maßnahmen etabliert, die sicherstellen, dass dieses Restrisiko auf ein absolutes Minimum reduziert wird und Einsender frühzeitig über mögliche Einschränkungen informiert werden, um eine optimale Patientenversorgung zu gewährleisten.
- Die Standardblutentnahme sollte möglichst am Morgen, idealerweise zwischen 08:00 und 09:00 Uhr, erfolgen. Der Patient sollte zuvor etwa 12 Stunden nüchtern sein.
- Die Staubinde wird etwa eine Handbreit oberhalb der Punktionsstelle angelegt. Der Staudruck sollte 50–100 mmHg betragen, sodass der Puls weiterhin tastbar bleibt. Die Stauzeit sollte nicht länger als eine Minute sein. Kein Faustschluss! Anschließend erfolgt die Auswahl der Punktionsstelle und die Desinfektion.
- Die Punktion erfolgt in Verlaufsrichtung der gewählten Vene. Hierbei wird die Haut mit leichtem Zug entgegen der Stichrichtung gespannt, wobei die Kanülenschliffseite nach oben zeigt.
- Bei Röhrchen mit Zusätzen (z. B. EDTA, Citrat, Heparin) ist unbedingt auf eine korrekte Füllung bis zum Markierungsstrich zu achten.
Abweichungen führen zu einem falschen Verhältnis zwischen Blut und Antikoagulans – die Probe ist dann für die Analyse nicht verwertbar. Nach erfolgreicher Punktion wird die Stauung gelöst.
-
Die Abnahmereihenfolge lautet:
a. Blutkulturen
b. Serumröhrchen (Nativblut)
c. Citratblut für Gerinnungsuntersuchungen
d. EDTA- bzw. Heparinblut
e. Fluoridblut -
Bei einer erfolglosen Punktion muss die Stauung sofort gelöst werden. Ein erneuter Versuch sollte möglichst am anderen Arm erfolgen; alternativ distal (handwärts) zur vorherigen Punktionsstelle.
-
Nach Entfernen der Kanüle ist die Punktionsstelle für etwa 5 Minuten mit einem Tupfer unter ausreichendem Druck zu komprimieren.
-
Direkt nach der Blutentnahme müssen alle Röhrchen mit Zusätzen (z. B. EDTA-, Citrat-Blut) durch mehrmaliges vorsichtiges Kippen oder Schwenken (ca. 5x) homogenisiert werden. Schütteln ist unbedingt zu vermeiden, da es zu Hämolyse oder anderen Probenveränderungen führen kann.
Blutuntersuchung:
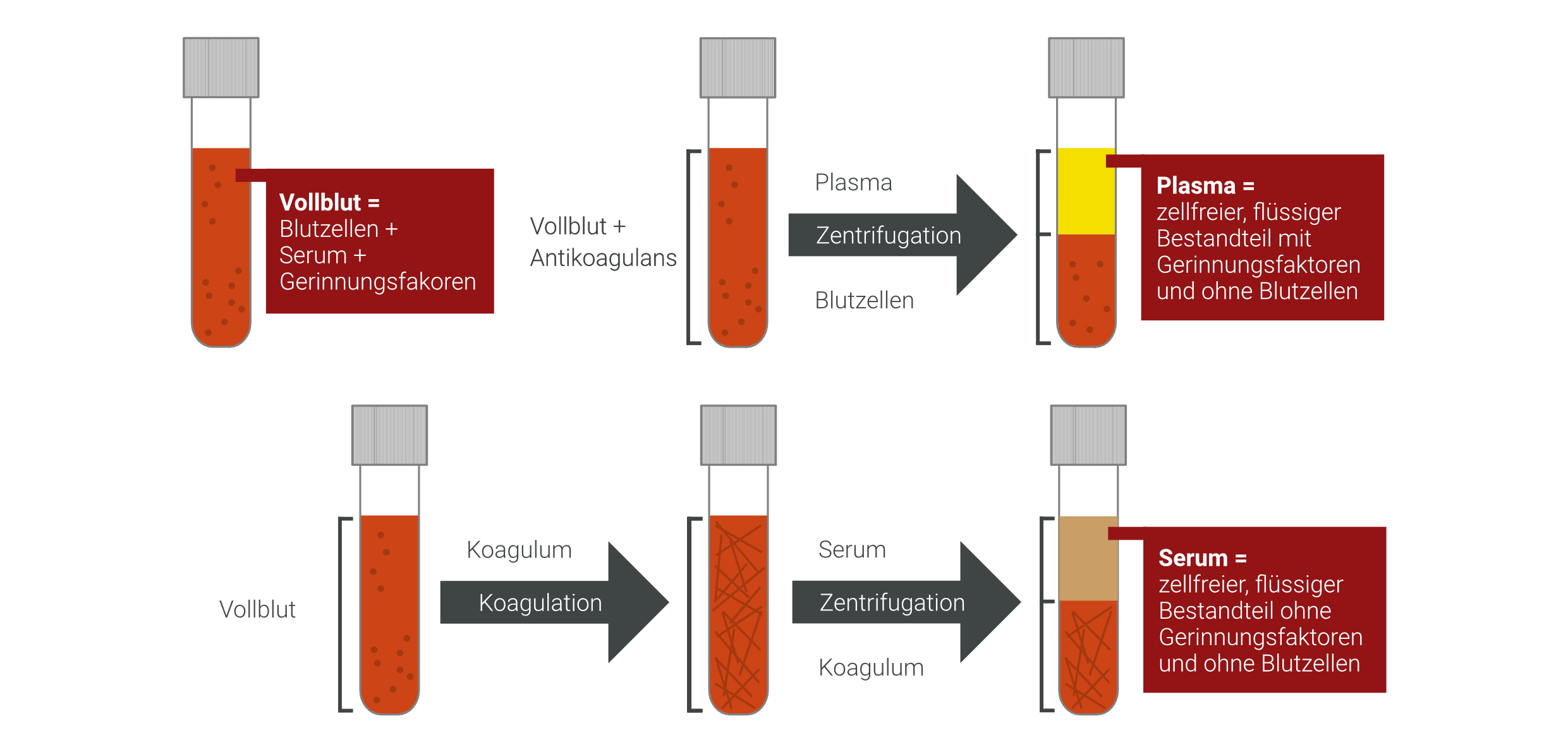
Vollblut enthält neben flüssigen Bestandteilen auch zelluläre Bestandteile (Erythrozyten, Leukozyten, Thrombozyten). Durch die Verwendung von speziellen Abnahmesystemen mit oder ohne beigefügtes Antikoagulantium erhält man das entsprechend benötigte Untersuchungsmaterial.
Bei Verwendung von z. B. Citrat als Antikoagulanzienzusatz, gerinnt das Vollblut nicht. So kann nach der Zentrifugation im Labor das Citrat-Plasma (zellfreier, flüssiger Bestandteil mit Gerinnungsfaktoren und ohne Blutzellen) für z. B. Gerinnungsanalysen gewonnen werden. Im Unterschied hierzu, gewinnt man Serum, indem man das Vollblutröhrchen ohne Zusätze ca. 30 min gerinnen lässt. Es bildet sich ein Blutkoagel. Durch die Zentrifugation erhält man Serum (zellfreier, flüssiger Bestandteil ohne Gerinnungsfaktoren und ohne Blutzellen) .
Je nach Anforderung wird entweder Serum oder Plasma benötigt. Genauere Angaben zum jeweiligen Analyten finden Sie in unserem
Analysenverzeichnis.
Bestandteile der Blutuntersuchung:
Bei der Gewinnung von Urinproben treten die häufigsten Fehler auf. Diese sind z. B. bedingt durch Sammelfehler, unsachgemäße genitale Reinigung sowie fehlerhafte Zusätze bei bestimmten Analyten.
Die Patienten sollten vor Gewinnung der Urinprobe genauestens über den Ablauf der Probengewinnung unterrichtet werden (erster / zweiter Morgenurin oder Mittelstrahlurin; genitale Reinigung). Bei bestimmten Analyten im Urin (z. B. 5-Hydroxyindolessigsäure, Katecholamine) ist eine Karenz von bestimmten Nahrungsmitteln unbedingt einzuhalten. Nähere Informationen finden Sie bei den jeweiligen Analyten im Analysenverzeichnis.
Bei Einsenden von Sammelurin muss die Sammelmenge (über 24 h) vermerkt werden.
| Gut zu wissen: Bitte beachten Sie, dass für die Diagnostik der erste Spontanurin für Status und Sediment sowie ein zweiter Spontanurin für Chlamydien- und Gonokokkennachweis benötigt wird. |
|
| Vor der Probennahme: | |
| Hände waschen
Waschen Sie Ihre Hände 30 Sekunden lang mit Wasser und Seife und trocknen Sie diese mit einem sauberen Handtuch. |
 |
| Intimbereich waschen Frauen: Spreizen Sie die Beine weit auseinander und reinigen die äußeren und inneren Schamlippen mit Wasser und ggf. einer milden (Intim-)seife. Trocknen Sie sich nur ab, falls Ihnen ein unbenutztes Handtuch oder sterile Tupfer zur Verfügung stehen. |
 |
| Männer:
Ziehen Sie mit einer Hand die Vorhaut zurück und waschen die Eichel mit Wasser und ggf. einer milden (Intim-)seife. Halten Sie die Vorhaut bis zum Ende der Urinabgabe zurückgezogen. |
 |
| Probennahme: | |
| Material: Sammelbecher mit Schraubdeckel | |
| 1. Lassen Sie die erste Urinportion in die Toilette laufen (ca. 3 Sekunden). Fangen Sie die mittlere Urinportion mit dem Becher auf, ohne das Wasserlassen zu unterbrechen (ca. 20 -30 ml). Achten Sie dabei darauf, dass der Becher den Körper nicht berührt. Die letzte Urinportion läuft ebenfalls in die Toilette. |  |
| 2. Verschließen Sie den Sammelbecher sorgfältig. Falls Urin an die Außenseite des Bechers gelangt ist, können Sie den fest verschlossenen Becher unter klarem Wasser abspülen. |  |
| Material: Einwegbecher, Urinröhrchen und Saugspitze | |
| 1. Lassen Sie die erste Urinportion in die Toilette laufen (ca. 3 Sekunden). Fangen Sie die mittlere Urinportion mit dem Becher auf, ohne das Wasserlassen zu unterbrechen (ca. 20-30 ml). Achten Sie dabei darauf, dass der Becher den Körper nicht berührt. Die letzte Urinportion läuft ebenfalls in die Toilette. | |
| 2. Tauchen Sie die Saugspitze in den Urin und ziehen die Kolbenstange am hinteren Ende des Röhrchens nach oben bis zur Markierung. (Falls keine Saugwirkung entsteht, drehen Sie das Röhrchen am unteren Ende leicht auf!) |  |
| 3. Drehen Sie die gelbe Kappe des Urinröhrchens ab. Setzen Sie stattdessen die lange Saugspitze auf die Spitze des Röhrchens. Die Kappe nicht wegwerfen! |  |
| 4. Drehen Sie das Röhrchen mit der Spitze nach oben und ziehen die Kolbenstange bis zum Anschlag auf, um die Saugspitze zu entleeren. | 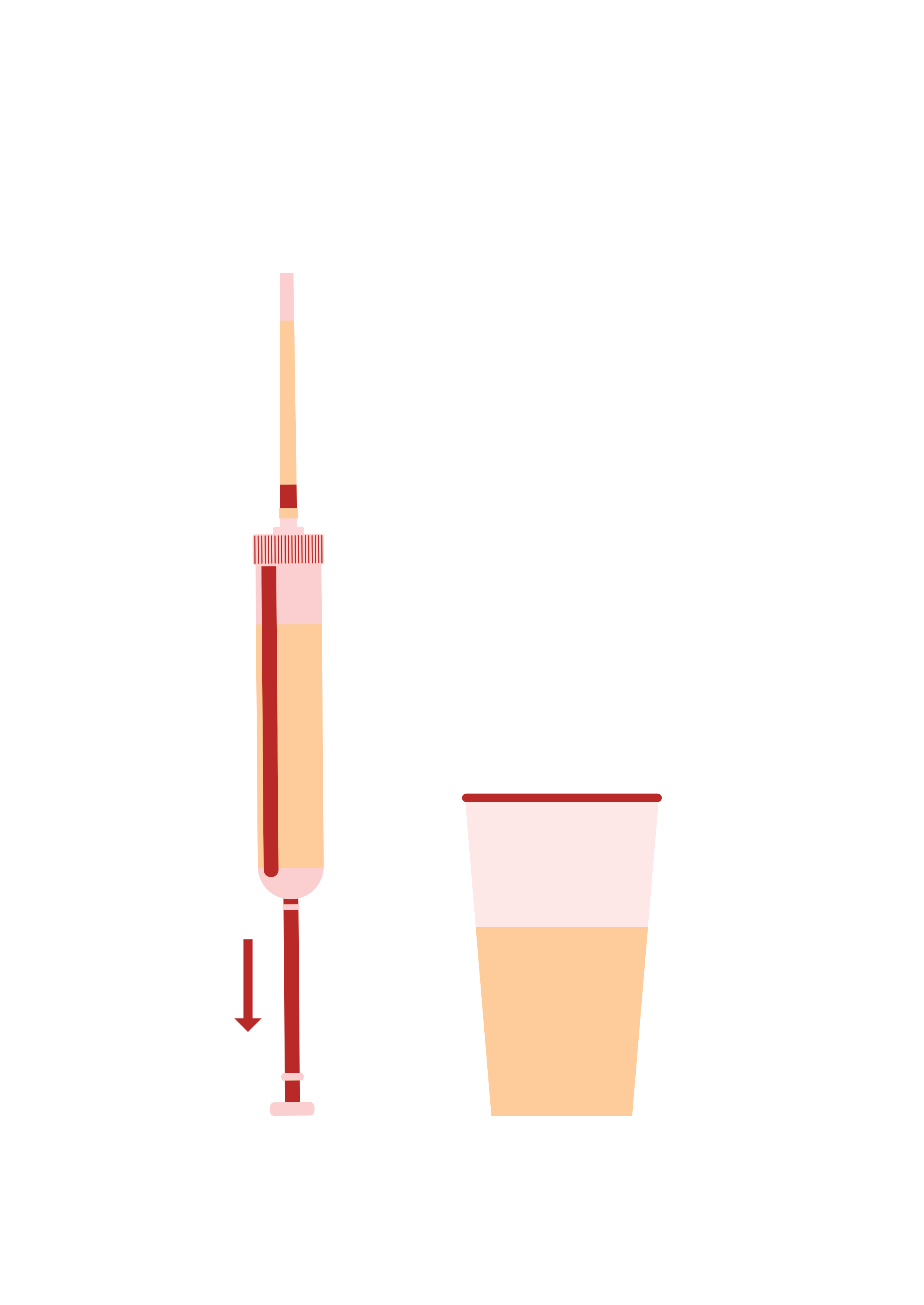 |
| 5. Entfernen Sie die Saugspitze und brechen Sie die Kolbenstange an der Perforierung ab. Setzen Sie die Kappe wieder auf. | 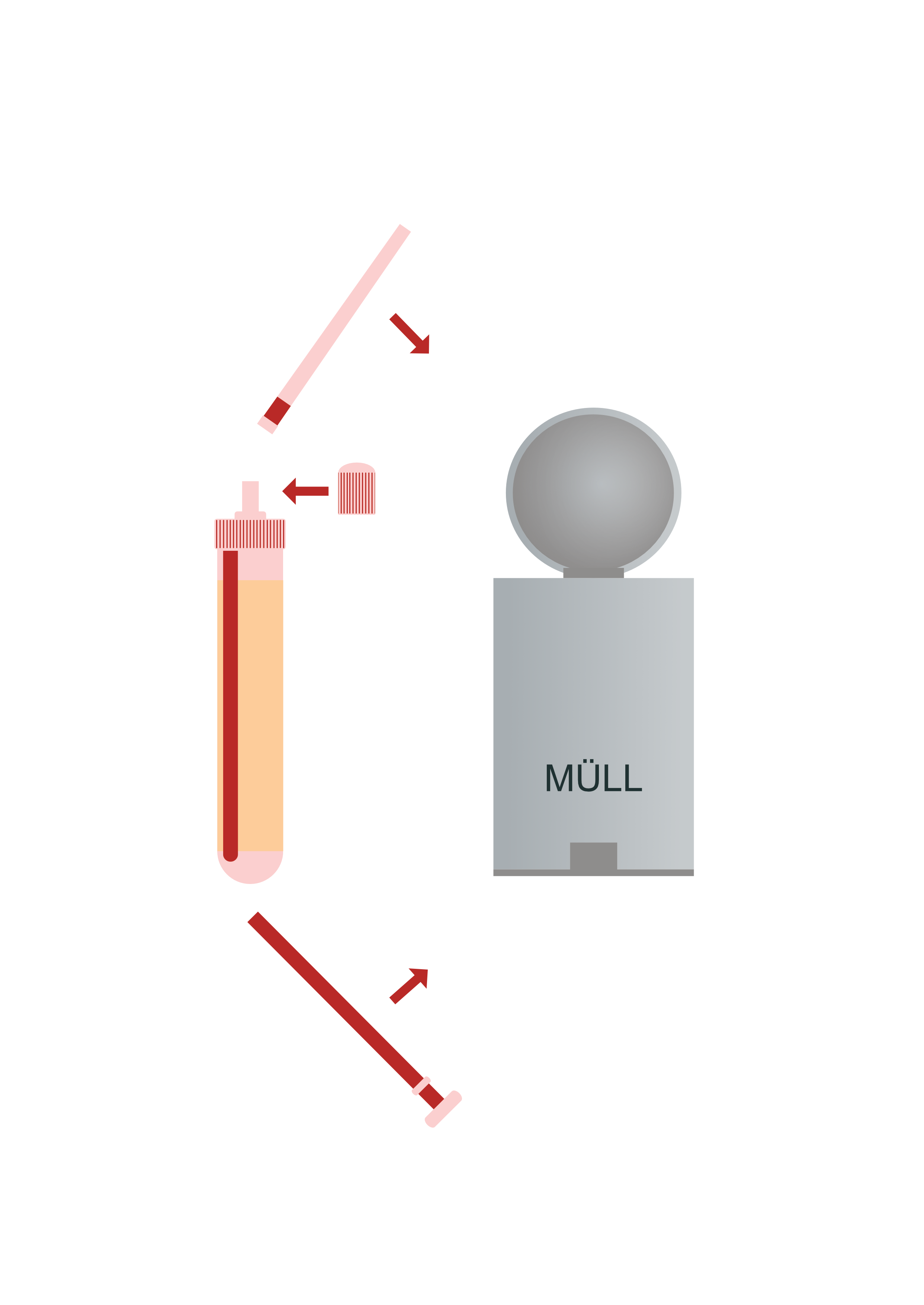 |
| Wichtiger Hinweis: | |
|
Nach der Gewinnung sollte Ihre Urinprobe schnellstmöglich ans Praxispersonal übergeben werden. Falls dies nicht sofort möglich ist, lagern Sie sie gut verschlossen im Kühlschrank. |
|
| 24 h - Sammelurin ohne Zusätze: | |
Wichtige Hinweise:
|
 |
| 24 h - Sammelurin angesäuert: | |
Wichtige Hinweise:
Achtung bei Verwendung der Salzsäure: Wenn „Vorsicht Säure“ auf dem Behälter steht: Ätzungsgefahr! Folgendes muss unbedingt eingehalten werden:
|
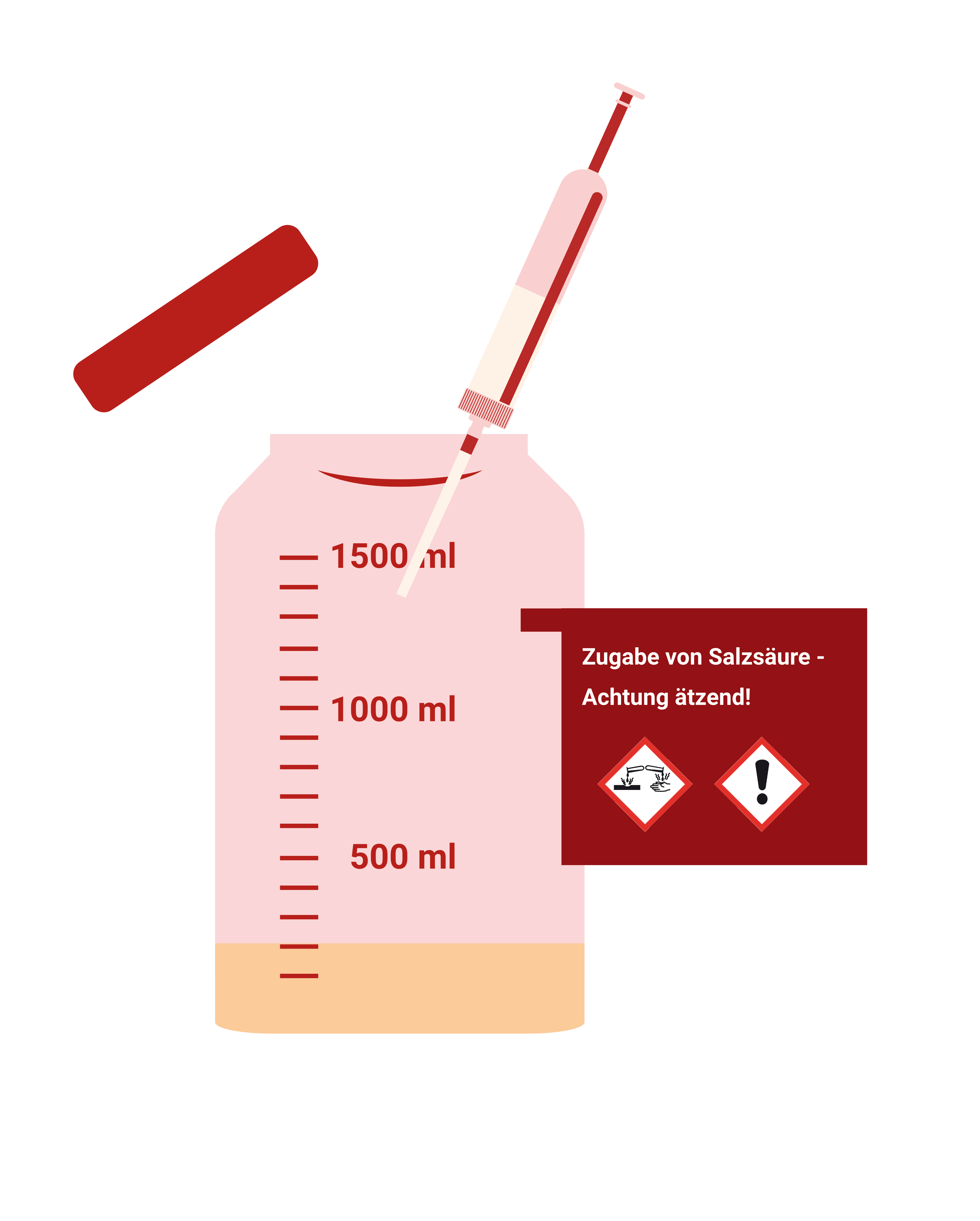 |
Nützliche Hinweise:
| Obligat mit Säurezusatz | Weitere Analysen, die aus angesäuertem Urin durchgeführt werden können | Obligat ohne Säurezusatz |
| Adrenalin | Anorganisches Phosphat | Albumin |
| Dopamin | Kalzium | Aldosteron |
| 5-HIES (5-Hydroxy-Indolessigsäure) | Delta-Aminolävulinsäure | Amylase |
| HVS (Homovanillinsäue) | Hydroxyprolin | Chlorid, Osmolalität, pH |
| Katecholamine | Kalium | Kortisol |
| Metanephrin | Kalium | Drogen |
| Noradrenalin | Magnesium | Harnsäure (Urat) |
| Normetanephrine | Natrium | Harnstoff, Kreatinin |
| Serotonin | Porphobilinogen | Porphyrine |
| VMS (Vanillinmandelsäure) | Proteine / Paraproteine | |
| Pyridinoline | ||
| Spurenelemente (im Spezial-Gefäß!) | ||
| Urinstatus |

Für Untersuchungen wie z.B. Elastase bzw. Calprotectin im Stuhl wird immer frischer, nativer Stuhl benötigt. Einige Stuhlparameter werden auf 1g Stuhl bezogen, daher ist die Verwendung der speziellen Stuhlröhrchen notwendig.
Der Löffel des Röhrchens nimmt ca. 1 g Stuhl auf.
Hinweis: Nähere Informationen für Stuhltest auf darmpathogene Keime finden Sie unter Präanalytik für Mikrobiologie.

Für die Untersuchung „okkultes Blut im Stuhl“ (iFOBT) beachten Sie bitte die Angaben zur korrekten Stuhlsammlung in der Patientenanleitung. Eine Überfüllung des Röhrchens (eine einmalige Probennahme ist ausreichend) bzw. eine Kontamination mit Stuhl an der Außenfläche des Röhrchens sollte vermieden werden.
Hinweis: Bitte bekleben Sie direkt das Probenröhrchen mit dem entsprechenden Barcode.

Synovialflüssigkeit, Aszites- und Pleurapunktat
Die Probenentnahme soll unter streng aseptischen Bedingungen erfolgen um eine bakterielle Kontamination zu vermeiden.
Zur Abnahme empfehlen wir folgende Probenröhrchen:
- Na-Heparin-Röhrchen für Zellzählung und Punktatbeurteilung, Kristallnachweis, klinisch-chemische Parameter (Auswahl)
- EDTA-Röhrchen für Zellzählung im Ausstrich (Anfertigung eines Ausstriches ab ≥ 100 Leukozyten)
- Steriles Röhrchen für Erreger- und Resistenznachweis (siehe auch Präanalytische Hinweise der Mikrobiologie)
- Für eine aussagekräftige Punktatdiagnostik ist die Anforderung als Komplettbeurteilung empfehlenswert

Hinweis: Bitte beachten Sie auch unseren Begleitzettel „Diagnostikbox Knochenmark“ mit wichtigen Hinweisen zur Wahl des richtigen Materials und weiteren Angaben.
Zum indirekten Nachweis einer Infektion mit Mykobakterium tuberculosis bitten wir um Einsendung von:

Hinweis: Beachten Sie bitte weiterhin die Abnahmebedingungen und das Zeitregime, d.h. aufgrund der sich anschließenden Inkubationszeit im Labor bitte keine Abnahme am Freitag bzw. direkt vor Feiertagen!
Weitere Hinweise finden Sie im Teil
Präanalytik für Mikrobiologie.
TDM dient der Optimierung individueller Medikamentenspiegel. Es hilft, die richtige Dosierung zu finden und Nebenwirkungen zu vermeiden, insbesondere bei Medikamenten mit engem therapeutischen Bereich.
Indikationen
Eine Spiegelbestimmung ist sinnvoll, wenn:
- ein enger therapeutischer Bereich besteht
- kleine Dosisänderungen relevante Spiegelveränderungen verursachen
- Langzeittherapie erfolgt
- Medikamente zur Behandlung schwerer oder lebensbedrohlicher Erkrankungen eingesetzt werden
- mehrere Medikamente gleichzeitig eingenommen werden
Probenentnahme
- Blutentnahme im Steady State, bevorzugt Talspiegel (vor nächster Einnahme)
- EDTA- oder Heparin-Plasma (Röhrchen ohne Gel)
- Angaben auf der Anforderung: Abnahmezeit/-datum, letzte Einnahme, aktuelle Medikation, Tal- oder Spitzenspiegel
- Optionale Verarbeitung/Transporthinweise: zeitnah zentrifugieren, Plasma gekühlt versenden
Die Beschriftung der Probengefäße sollte vor der Entnahme erfolgen und nochmals bei der Probennahme kontrolliert werden, um die Verwechslungsgefahr so gering wie möglich zu halten.
Die Probengefäße (nicht Schutzhülle/Umverpackung) sollten mit
10- stelligem Barcode und/oder Name, Vorname, Geburtsdatum
beschriftet werden. Das Probenmaterial und der zugehörige Untersuchungsauftrag müssen einander eindeutig zuzuordnen sein, sonst können die angeforderten Untersuchungen nicht durchgeführt werden.
Bei Funktionstesten (Stimulations-/Suppressionstesten) und Tagesprofilen bitte jedes Röhrchen mit dem jeweiligen Entnahmezeitpunkt bzw. der Angabe des Stimulans/Suppressivum eindeutig kennzeichnen.
Blutgruppenserologische Diagnostik
(Blutgruppenbestimmung/Antikörper-Suchtest, Coombs-Test, Kreuzproben) dürfen laut Punkt 4.4.3 der Richtlinie für Hämotherapie nur aus vollständig und korrekt beschrifteten Probenröhrchen (Name, Vorname, Geburtsdatum, zusätzlich in codierter Form) durchgeführt werden! Bitte senden Sie uns hierzu ein separates Röhrchen ein. Hierfür ist EDTA-Blut das Material der ersten Wahl!
Für molekularbiologische Diagnostik
(HLA-B27, Laktose- und Fructoseintoleranz, Hämochromatose, etc) ist nach Gendiagnostikgesetz die Einverständniserklärung des Patienten zwingend notwendig. Die Unterschrift auf dem Überweisungsschein reicht hierfür nicht aus.
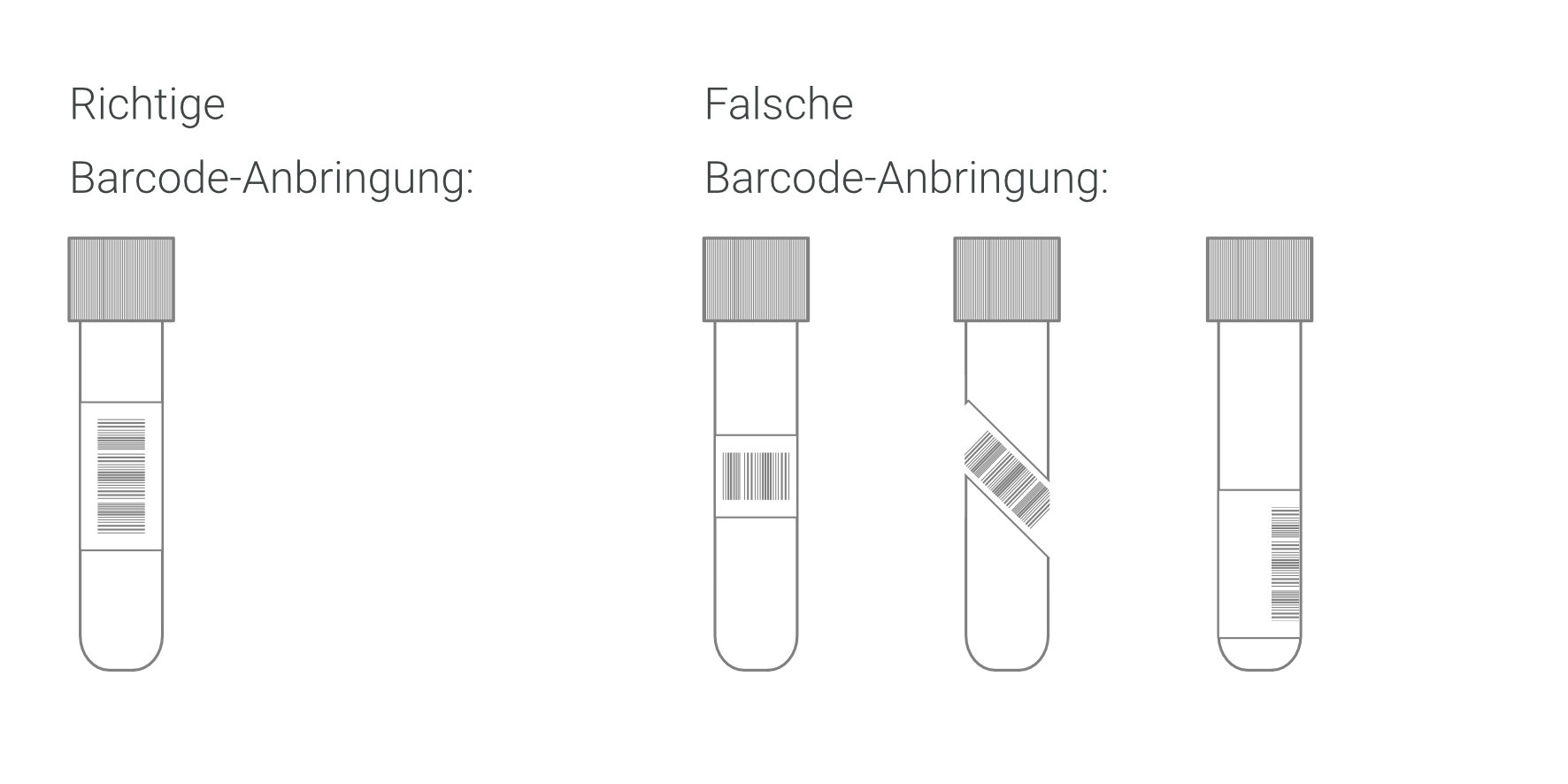
Bitte kleben Sie den Barcode senkrecht auf das Probenröhrchen auf.
Für die Anforderung von Laborleistungen stehen Ihnen folgende Überweisungs- bzw. Anforderungsscheine zur Verfügung.
| Bezeichnung | Leistungen | Leistungserbringer | Bemerkungen |
| Muster 10 |
Allg. und spez. Laboruntersuchungen |
Laborpraxis | Muster 10-Schein bitte auch für Privatpatienten nutzen |
| Anforderungsschein Muster 10A |
Allg. Laboruntersuchungen
|
Laborgemeinschaft | |
| Muster 10 Kombischein |
Allg. und spez. Laboruntersuchungen
|
Laborpraxis | Kombischein bitte auch für Privatpatienten nutzen |
| Muster 10PL | Allg. Laboruntersuchungen (OI/OII) |
Laborgemeinschaft |
Privat und OP-Vorbereitung (eigene Rechnungslegung an Praxis)
|
| IGeL-Schein |
Allg. und spez. Laboruntersuchungen
|
Laborpraxis |
Individuelle Gesundheitsleistung
|
| GYNENDO-Schein | Gynäkologische Endokrinologie (mit verbaler Beurteilung) |
Laborpraxis |
Angabe zu Größe, Gewicht, Zyklustag, Zykluslänge |
| Autoimmunologie | Autoimmundiagnostik nach Stufenschema | Laborpraxis |
Jeder verwendete Anforderungsschein sollte zur korrekten und umfassenden Befunderstellung folgende Angaben obligat erhalten:
- Vollständige Einsenderangaben (LANR, BSN, etc.), Stempel und Unterschrift des einsendenden Arztes
- Name, Vorname, Geburtsdatum, Geschlecht der Patientin / des Patienten
- Versicherten- / Krankenkassen-Nummer, Adressdaten
- Art und Entnahmestelle des Untersuchungsmaterials (z. B. bei Abstrichmaterial, Punktat)
- Entnahmezeitpunkt (Datum und Uhrzeit der Probenentnahme)
- Relevante Angaben zur laufenden Medikation
- Angabe von „EILT“-Proben
- In jedem Fall Angaben zur Diagnose oder Verdachtsdiagnose (ICD-Nr.)
- Blutgruppenbestimmung und Antikörpersuchtest im Rahmen der Mutterschaftsvorsorge: Angaben zur Rhesusprophylaxe und SSW
- Gynäkologische Endokrinologie: Angaben zu Größe, Gewicht, Zyklustag, Zykluslänge
- Pränatale Risikodiagnostik: Angaben zu SSW, Gewicht, Raucherstatus
- Genetische Untersuchungen: Einverständniserklärung mit Unterschrift des Patienten – zusätzlich mit Barcode versehen
Darüber hinaus müssen fakultative Angaben gemacht werden: Differentialdiagnosen, Symptome, Verweis auf Vorbefunde / bestehende interdisziplinäre Befunde, Anamnese (v. a. Impfanamnese, Reiseanamnese, Medikamentenanamnese, etc.).
Bei individuellen Gesundheitsleistungen (IGeL) und Privatpatienten ist die Unterschrift des Patienten auf dem Anforderungsschein als Einverständnis der Weitergabe der persönlichen Daten erforderlich.
Die korrekte Reihenfolge der Blutabnahme ist ein wesentlicher Bestandteil der Präanalytik. Sie verhindert, dass Zusatzstoffe aus einem Röhrchen (z. B. Antikoagulanzien wie EDTA oder Heparin) in ein anderes Röhrchen übergehen und dadurch Laborparameter verfälscht werden.
Ein fachgerechtes Vorgehen minimiert damit präanalytische Fehlerquellen und gewährleistet zuverlässige und vergleichbare Messergebnisse. Da verschiedene Hersteller unterschiedliche Systeme und Farbcodes verwenden, ist es wichtig, die jeweilige Abnahmereihenfolge für das eingesetzte System (z. B. Sarstedt oder BD) zu beachten.
Unsere Übersicht unterstützt Sie dabei, die korrekte Röhrchenreihenfolge sicher und schnell im Arbeitsalltag umzusetzen – für maximale Qualität in der Laboranalytik.
Zentrifugation - Verwendung einer Zentrifuge mit Ausschwingrotor
Hinweise zur Probenvorbereitung:
- Die Blutprobe aufrecht stehend vollständig gerinnen lassen, bevor sie zentrifugiert wird.
- Nach abgeschlossener Gerinnung sollte das Vollblut zur Serumgewinnung mindestens 10 Minuten bei 1500 × g (RZB) zentrifugiert werden.
- Die korrekte Zentrifugationsgeschwindigkeit und -dauer sind entscheidend für eine präzise und zuverlässige Analyse der Blutproben.
- Während der Zentrifugation wird die Schwerkraft um das Hundert- bis Tausendfache verstärkt. Dadurch sinken die festen Blutbestandteile (z. B. Erythrozyten und Zelltrümmer) auf den Boden des Röhrchens ab, während sich der flüssige Überstand (Serum) in der oberen Schicht, oberhalb des Trenngels, sammelt.
Die folgende Darstellung zeigt eine Zentrifuge mit Ausschwingrotor:
Als Probenmaterial bezeichnet man jede vom Patienten entnommene biologische Substanz, die zur diagnostischen Untersuchung im medizinischen Labor dient. Dazu zählen unter anderem Blut, Urin, Stuhl, Speichel, Gewebeproben oder Abstriche.
Das Probenmaterial bildet die Grundlage für die labordiagnostische Analyse und ermöglicht die Erkennung, Überwachung und Verlaufskontrolle von Erkrankungen.
Die korrekte Entnahme, Kennzeichnung, Lagerung und der fachgerechte Transport des Probenmaterials sind entscheidend für die Qualität und Zuverlässigkeit der Analyseergebnisse.
Nachfolgend geben wir einen Überblick über die verschiedenen Probenmaterialien, die in unserem Labor untersucht werden.
Allgemeines Probenmaterial:
Antikoagulanziencode nach ISO DIN 6710 bzw. EN 14820:
| Probenmaterial | Sarstedt Monovette® / Kabevette® Euronorm Kodierung (EN 14820) |
Vacutainer® / Vacuette® Internationaler Farbcode (DIN/ISO 6710) |
| Serum | weiß | rot (braun) |
| Serum mit Trennhilfe | braun | goldgelb (braun/schwarz) |
| EDTA-Blut | rot | violett |
| Citrat-Blut [1+92, Gerinnung] | grün | hellblau |
| Citrat-Blut [1+42, BSG] | violett | schwarz |
| Na/NH4-Heparin Blut | blau | grün |
| Li-Heparin Blut | orange | orange / grün |
| Fluorid [NaF + Oxalat] | gelb | grau |
Sonstiges Probenmaterial:
Molekularbiologische Proben:
Die für PCR-Analytik benötigten Materialien und Probennahmegefäße sind von Analyt zu Analyt verschieden. Für genomische Untersuchungen wird EDTA-Blut bevorzugt. Für molekularbiologische Erregernachweise EDTA-Blut, Liquor bzw. Abstrichtupfer einsenden. Die Lagerung und der Versand sollten bei + 2 bis +8 °C erfolgen. Bitte vergessen Sie bei molekulargenetischen Untersuchungen nicht die Einwilligungserklärung des Patienten gemäß der Richtlinie der Gendiagnostik-Kommission (GEKO).
Cerebrospinalflüssigkeit (Liquor):
Je nach Fragestellung entsprechende Röhrchenanzahl bereitstellen. Röhrchen in der Reihenfolge der Entnahme beschriften und Entnahmezeitpunkt vermerken. Der Liquor wird direkt nach der Entnahme verteilt.
Das erste Röhrchen mit ca. 2 ml Liquor für Parameter die rasch zu bearbeiten sind, sollte möglichst zeitnah (innerhalb von 2 Stunden) ins Labor gebracht werden. Dazu zählen die Zellzahl, die Zelldifferenzierung, Glukose und Laktat.
Nach Möglichkeit bitten wir um ein zweites steriles Röhrchen mit ca. 3 ml Liquor für die Infektionsserologie wie z.B.: Masern-, HSV- und VZV-Nachweis mittels PCR.
Zur Erstellung eines Reiber-Diagramms, Bestimmung oligoklonaler Banden und/oder Berechnung des Antikörper-Spezifitäts-Index (ASI) als Paralleluntersuchung benötigen wir zusätzlich Serum, welches idealerweise zeitgleich gewonnen wird.
Spermiogramm (WHO konform), Spermiogramm nach Vasektomie:
Gewinnung des Spermaprobe unter „standardisierten Bedingungen“.
Einhaltung der sexuellen Karenz (kein Geschlechtsverkehr bzw. Masturbation) zwischen 2 –7 Tagen. Gewinnung der Spermaprobe am Untersuchungstag möglichst gegen 07:00 Uhr unter häuslichen Bedingungen durch Selbstbefriedigung (nicht durch Coitus interruptus) in geeignete Gefäße (keine Nutzung von handelsüblichen Kondomen) gewonnen werden, diese erhalten Sie bei Ihrem behandelnden Urologen bzw. direkt im Labor.
Die vollständige Gewinnung des Spermas ist erforderlich, da die Spermamenge bei der Untersuchung berücksichtigt wird. Nach Gewinnung der Spermaprobe muss diese innerhalb einer Stunde bei Körpertemperatur (am Körper oder in der Hosentasche) ins Labor gebracht werden. Wichtige Angaben zu Probengewinnung, sexuelle Karenz, Vollständigkeit der Probe vermerken Sie auf der Patienteninformation, diese wird zusammen mit der Probe im Labor abgegeben.
Die Qualität eines Laborergebnisses beginnt bereits vor der Analyse – bei der richtigen Handhabung und Lagerung der Probe.
Schon geringe Abweichungen in Temperatur oder Zeit können Messergebnisse verändern und zu Fehlinterpretationen führen.
Eine korrekte Lagerung sorgt für:
- Stabile Analytkonzentrationen
- Verlässliche und reproduzierbare Resultate
- Vermeidung unnötiger Wiederholungsuntersuchungen
Bitte beachten Sie:
Jedes Material erfordert spezifische Lagerungsbedingungen. Die nachfolgende Übersicht soll Ihnen helfen, diese rasch und sicher umzusetzen.
Allgemeine Grundsätze zur Lagerung von Proben:
Je nach Material:
Raumtemp. (15–25 °C), Kühlung (2–8 °C) oder Gefrieren (−20 °C / −80 °C)
| Aspekt | Empfehlung | Hinweise |
|---|---|---|
| Temperatur | Je nach Material: Raumtemp. (18–25 °C), Kühlung (2–8 °C) oder Gefrieren (−20 °C / −80 °C) | Temperaturschwankungen vermeiden |
| Lagerdauer | So kurz wie möglich | Verzögerungen können Werte verändern |
| Zentrifugation | Serum/Plasma möglichst innerhalb von 2 h nach Entnahme | Verzögerte Trennung kann zu Hämolyse führen |
| Transport | Kühlbox oder Thermobehälter verwenden | Direkte Sonneneinstrahlung vermeiden |
| Beschriftung | Vollständig, leserlich, eindeutig | Mit Patienten-ID und Entnahmedatum |
Lagerung nach Materialtyp:
| Analyse | Lagerungsbedingungen |
| Serum / Zentrifugiertes Röhrchen | |
| Alle Analysen | Kühlung (2-8 °C) |
| Vollblut / Unzentrifugiertes Röhrchen | |
| Alle Analysen | Raumtemp. (15-25 °C) |
| EDTA-Blut | |
| Blutbildanalyse | Raumtemp. (15-25 °C) - nur am selben Tag! |
| Hb-Elektrophorese, Histamin, Vit. B1/B2/B6 | Kühlung (2-8 °C) |
| Kälte-(Auto-)antikörper | Raumtemp. (15-25 °C), Neutralröhrchen (gelfrei), Beschriftung mit Name & Geburtsdatum Komplexe Präanalytik beachten! |
| Lymphozytentypisierung | Raumtemp. (15-25 °C) - am selben Tag einsenden! |
| Molekularbiologie | Kühlung (2-8 °C), separates, ungeöffnetes Röhrchen |
| Viruslast (HIV, Hepatitis) | Kühlung (2-8 °C) |
| Citrat-Blut / Plasma | |
| Hämostaseologische Analysen | Raumtemp. (15–25 °C), am selben Tag einsenden Wenn verzögert, dann Citrat-Plasma unbedingt tiefgefroren einsenden! |
| Liquor (idealerweise Liquor/Serum-Paar) | |
| Protein-Diagnostik / Klinische Chemie | Kühlung (2–8 °C), innerhalb von 2 h einsenden |
| Urin | |
| Ohne Stabilisator | Kühlung (2-8 °C) |
| Mit Stabilisator | Raumtemp. (15-25 °C) - ideal Kühlschrank (2-8 °C) |
| Heparin-Blut | |
| QuantiFERON TB Gold Plus | Raumtemp. (15-25 °C) - zügig ins Labor, nicht freitags oder vor Feiertagen einsenden |
| Basophiler Aktivierungstest | |
| BAT | Raumtemp. (15–25 °C) - zügig ins Labor, nicht freitags / vor Feiertagen Im Hochsommer: Kühlung (2-8 °C) empfohlen. |
Innerhalb des Einzugsgebietes unseres Labors werden die Proben durch den Fahrdienst abgeholt. Falls Sie zusätzlich noch einen Fahrdienst bestellen oder abbestellen wollen, kontaktieren Sie uns bitte unter
- Standort Bautzen: 03591 4890-60
- Standort Görlitz: 03581 6693-131
- Standort Dresden: 0351 3140610-377
Frostversand:
Kühlboxen sind kostenlos im Labor erhältlich. Die Styroporhülle bitte entfernen und die enthaltenen Abnahmesysteme bei ≤ 18 °C im Gefrierfach lagern. Das eingefrorene Material, z. B. Serum oder Plasma (nie Vollblut!), in den Behälter geben und im Styroporkarton verschicken. Die Proben bleiben etwa 24 h gekühlt.
Cave! Postversand nicht über das Wochenende verschicken.
Speichelproben ermöglichen eine schnelle und zuverlässige Erfassung von Drogen.
Voraussetzung zur Probengewinnung
- 10 Minuten vor der Entnahme nichts essen oder trinken
- Mund mit Wasser ausspülen
- Hände gründlich waschen
- Entnahmeset erst kurz vor der Anwendung öffnen
Durchführung
- Sammelpad im Mund belassen, bis er ausreichend Speichel aufgenommen hat
- Pad in das Transportröhrchen mit Pufferlösung einführen
- Röhrchen verschließen und korrekt kennzeichnen
Nachbereitung
- Probe zeitnah an das Labor übergeben
- Entnahme sollte von geschultem medizinischen Personal begleitet werden
Haaranalysen zeigen den konsumierten Substanzverlauf über mehrere Monate.
Allgemeines
- Haaranalysen ermöglichen den Nachweis konsumierter Substanzen über mehrere Monate.
- 1 cm Haarlänge entspricht ca. 1 Monat rückblickendem Substanzgebrauch.
Voraussetzung
- Prüfung der Identität des Probanden
- Entnahme zweier Haarsträhnen am Hinterkopf, proximal direkt an der Kopfhaut
- Dokumentation von Haarfarbe und Länge
- Gewinnung erfolgt idealerweise im Beisein eines Zeugen, optimal durch Staatsanwalt oder Notar; diese Personen sollten auch den Postversand übernehmen
Durchführung
- Abnahme eines bleistiftdicken Haarbüschels (mind. 1 – 6 cm Länge) direkt am Haaransatz.
- Entnahme auf beiden Seiten des Hinterkopfs möglich.
- Strähnen bzw. das Haarbüschel mit Faden oder Gummiring fixieren, um ein Verrutschen zu verhindern.
- Wachstumsrichtung eindeutig kennzeichnen.
- Fixierte Haare auf dem Protokollbogen befestigen (z. B. Klebestreifen) und lichtgeschützt in Alufolie verpacken
Sicherheit
- Manipulationen verhindern (klare Dokumentation, Zeugenprinzip).
- Probe trocken und lichtgeschützt lagern und versenden.
- Bei speziellen Fragestellungen vorab Rücksprache mit dem Labor halten.
Urinanalysen dienen dem Nachweis von Drogenkonsum und Alkoholabstinenz.
Identitäts- und Probensicherung
- Vorlage eines gültigen Ausweises
- Urinabgabe unter Aufsicht
- Temperaturkontrolle direkt nach Abgabe
- Probe A & Probe B: zweite Probe für Nachuntersuchungen
- Bei Manipulationsversuch: Abbruch des Programms
Grundlagen
- Phosphatidylethanol (Peth) = neuartiger Parameter zur Alkoholmarkerbestimmung
- Im Gegensatz zu EtG: Bildung nur in Erythrozyten, nicht in Leber oder Gastrointestinaltrakt
- Bildung aus Phospholipid Phosphatidylcholin in Anwesenheit von Ethanol durch das Enzym Phospholipase D
- Material: Venöse Blutabnahme, 1 EDTA-Monovette
Interpretation der PEth-Konzentration
- > 210 ng/ml: regelmäßiger bzw. gewohnheitsmäßiger Alkoholkonsum („riskful drinking“)
- 20 – 210 ng/ml: gelegentlicher, mäßiger Konsum („social drinking“)
- < 100 ng/ml: kontrolliertes Trinken
- < 20 ng/ml: Alkoholabstinenz oder sporadischer Konsum